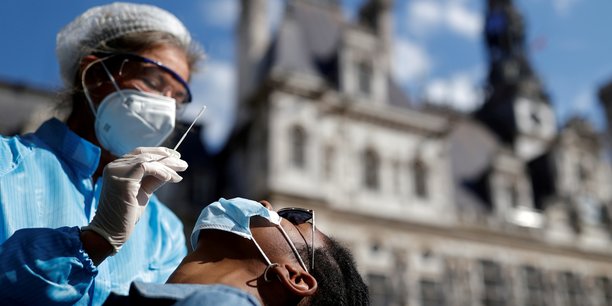
Sous la menace d'une deuxième vague, Olivier Véran bouscule les procédures en cours. Alors que le nouveau test Covid rapide SD Biosensor est actuellement évalué dans les hôpitaux de Paris AP-HP, un décret du ministre de la Santé publié hier mercredi autorise leur utilisation de façon exceptionnelle, avant même d'avoir reçu l'avis des sociétés savantes sur le sujet. Ces tests seront utilisé pour une "orientation diagnostique" et feront l'objet d'une confirmation par RT-PCR s'ils se révèlent positifs.
Certains laboratoires dénoncent déjà une décision trop rapide avant la confirmation de l'intérêt de ces tests. Mais après avoir pris un mois de retard en février pour lancer la fabrication des tests dont l'institut Pasteur avait transmis le modèle au Centre national de référence, comme l'a révélé le corapporteur de la Commission d'enquête sur la gestion du COVID-19), le gouvernement a décidé cette fois de mettre la charrette aussi vite que possible devant les boeufs.
Tests antigéniques : des résultats délivrés en 30 min
Effectué sur des prélèvements dans les narines, le test antigénique de diagnostic rapide (TDR) a l'avantage de délivrer ses résultats en une demi-heure. Son astuce : détecter les protéines virales (antigènes) présentes dans la structure du coronavirus comme les protéines Spike qui le recouvrent.
À la différence des tests utilisés jusqu'à présent - dits RT-PCR - qui recherchent des traces du matériel génétique ARN du même virus, après l'avoir extrait et amplifié pour qu'il soit détectable. L'évaluation de l'AP-HP "en vie réelle" déterminera plus précisément l'intérêt de ces tests dans la stratégie sanitaire de dépistage et leur degré de sensibilité. Mais leur déploiement par les ARS pour les clusters supposés permettra peut-être de gagner du temps pour identifier les chaînes de contamination plus rapidement.
Avant de choisir le test SD Biosensor, l'AP-HP avait déjà pré-évalué deux TDR cet été: le test coréen, mais aussi un test belge de Coris. Pour mesurer leurs compétences, 700 prélèvements, dont la moitié positifs confirmés par RT-PCR, avaient été soumis à ces deux kits. Comme l'explique le ministère de la Santé :
« Les résultats ont montré que le test Biosensor, qui dispose d'un marquage CE, est efficace selon la définition de l'OMS. L'AP-HP a donc commandé 100.000 tests Biosensor (...) pour pouvoir envisager leur mise en œuvre dans le cadre de la politique de dépistage. »
Ce seront bien ces tests qui seront déployés par les ARS pour des dépistages collectifs en cas de besoin.
L'OMS pousse au dépistage massif
Depuis le début de la pandémie, l'OMS pousse tous les pays à pratiquer un dépistage massif. Mais les autorités de santé ont mis du temps à disposer de tests efficaces. Si les RT-PCR ont été rapidement assez fiables pour être utilisés, les biotechs qui développaient des tests antigéniques ont eu besoin de cinq mois pour obtenir le feu vert cet été. Le premier TDR est celui du laboratoire américain Abbott, avec son kit BinaxNOW autorisé par la Food and Drug Administration FDA fin août.
Depuis, différentes biotechs soumettent leur kit aux autorités de santé. Roche Diagnostic - qui travaillait déjà en accord avec SD Biosensor sur un test rapide anticorps - devrait commercialiser son TDR en cours d'évaluation à l'AP-HP d'ici la fin du mois. Il espère le voir autorisé, mais aussi remboursé par l'Assurance maladie dans le meilleur des cas. A quel tarif ? Alors que le BinaxNOW a été commercialisé par Abbott à 5 dollars le kit, le laboratoire suisse annonce son test à un prix équivalent partout dans le monde.
Dépister + retracer + isoler
Depuis cet été, la montée en charge du testing a été très forte : le ministère de la Santé annonce plus d'un million de tests par semaine début septembre. Il déplore que « des tensions importantes existent avec des difficultés pour pouvoir se faire tester, des délais parfois longs pour avoir accès au test et obtenir le résultat. » (de deux jours à plus de cinq, ndlr). Avec plus de 9.500 nouvelles contaminations recensées en 24 heures en fin de semaine dernière, les demandes de dépistage plus ou moins justifiées sont énormes. Les laboratoires d'analyses médicales se retrouvent saturés.
Après le Conseil de Défense du 11 septembre, le Premier ministre Jean Castex a admis que les délais d'attente pour les résultats des tests COVID-19 étaient « trop importants ». Il a annoncé des créneaux horaires en labo réservés aux personnes prioritaires, comme les patients symptomatiques, les cas contacts rapprochés et les personnels soignants. Pour gérer la pandémie sans avoir à reconfiner en masse, une stratégie de tests systématiques et rapides aiderait à mieux suivre les cas contacts, à n'isoler que les personnes contagieuses et seulement le temps nécessaire. Déjà, la durée de la quarantaine a été réduite vendredi dernier de quatorze à sept jours et le gouvernement tente de décourager le testing systématique des anxieux.
Vers la fin du tout RT-PCR ?
Si les résultats de l'évaluation actuelle ont été annoncés pour cette semaine, la stratégie sanitaire actuelle devra déterminer comment positionner ce test antigénique dans la politique de testing. Le TDR fonctionne un peu sur le modèle des tests de grossesse. Le prélèvement nasal par écouvillon est déposé sur un dispositif, où il se mélange au réactif. Ensuite, ce mélange induit ou non l'apparition d'une bande, suivant la présence ou l'absence des antigènes du virus.Le résultat en quelque 30 minutes maximum permet un gain de temps utile pour isoler les contaminants bien plus tôt et identifier leurs contacts plus rapidement. Pour l'instant, la pratique est de confirmer les cas positifs de ces tests antigéniques par un RT-PCR classique. En même temps, le test TDR semble moins sensible que le RT-PCR. Du coup, à moins d'un défaut de manipulation, les cas positifs qu'il détecte ont déjà une forte charge virale, ce qui ne peut qu'être confirmé par le sensible PCR qui détectent le matériel génétique du virus même à très faible dose.
Alors que les laboratoires sont saturés, les autorités de santé se demandent aussi comment positionner ces tests. Seront-ils classés comme des "Tests de diagnostic rapide", uniquement réalisés par les laboratoires d'analyse ou leurs équipes ? Ou bien dans la catégorie "Test rapide d'orientation diagnostic", qui peuvent être utilisés hors des laboratoires, par des professionnels de santé médecins, infirmiers ou pharmaciens?
Au micro de France Inter, Olivier Véran a estimé que leur utilisation serait « bien dans certains milieux, comme les aéroports » ou « à l'accueil des hôpitaux ». Et selon Michel Guyon, directeur marketing de Roche Diagnostics France :
« Ils pourraient être davantage utilisés en première intention chez les patients symptomatiques pour déterminer ou non la présence du virus en peu de temps. »
Pour le déploiement massif de ces tests, un protocole d'essais cliniques doit être déposé pour une étude TDR + RT-PCR en parallèle de l'évaluation hospitalière. Cette double procédure illustre la fébrilité des autorités de santé, soucieuses d'améliorer encore le rythme des détections afin d'endiguer au plus vite une deuxième vague. Pour son test rapide, Abbott annonce une production de 50 millions de kits par mois, Roche commence avec 40 millions, pour arriver à 90 millions mensuels dici la fin de l''année.
Tests salivaires, l'autre piste
En attendant, une autre piste est celle des tests salivaires avec le kit EasyCov mis au point par le laboratoire CNRS de Montpellier Sys2Diag. En France, ces tests ne sont pas encore approuvés par les autorités de Santé qui mettent en cause leur faible sensibilité. En effet, ils ne se révèlent positifs que lorsque les patients sont vraiment fortement infectés.
Mais au moment où les médecins comprennent que la contagion est liée à la quantité de charge virale, ces tests constituent une alternative intéressante. Ils sont beaucoup plus simples à réaliser, alors que l'engorgement actuel des laboratoires est en partie liée au temps de prélèvement par écouvillon et à sa concentration. En juillet, Olivier Véran avait déjà mis la pression sur l'AP-HP pour avancer sur cette question.
« J'attends de façon imminente des résultats d'expérimentations qu'on a menées sur des populations importantes », a-t-il indiqué sur France Inter.
L'approche multitests
Enfin, une autre stratégie est la mise au point de multitests, comme le projet du laboratoire Roche de RT-PCR différenciant la grippe du COVID-19 face aux symptômes similaires. Comme l'explique Michel Guyon :
« Nous travaillons aussi sur un test sérologique quantitatif dirigé contre la protéine Spike, afin de titrer les anticorps présents dans le sang du patient, ce qui sera très utile de connaître lorsque les vaccins arriveront. »
Alors que les premiers cas de réinfection commencent à être analysés avec des virus présentant des mutations génétiques, l'immunité provoquée par le COVID-19 est remise en question. Les laboratoires s'interrogent sur le risque de devoir effectuer des rappels réguliers lorsque le vaccin sera mis au point.
Mixer les approches pour être plus offensifs
Loin de s'opposer, tous ces différents axes pourraient se révéler complémentaires dans le cadre d'une stratégie de dépistage plus offensive. Isabelle Tongio, présidente du Syndicat de l'industrie du diagnostic in vitro (Sidiv), le souligne en ces termes:
« Les industriels se mobilisent pour mettre au point de nouveaux tests qui pourraient optimiser les analyses de biologie médicale de détection du SARS-COV-2 en permettant de diversifier les solutions technologiques, de fluidifier les parcours et de réduire les temps d'analyse, sans compromis sur la qualité et la performance des tests et dans le respect de la réglementation d'évaluation et de commercialisation en vigueur. »
Elle précise que ses adhérents consacrent « en moyenne 11% de leur chiffre d'affaires à la R&D ».
Les différents marchés potentiels qui s'ouvrent aiguisent les appétits. Il faut dire que les enjeux financiers sont de taille alors que le coût des tests RT-PCR pris en charge à 100% depuis fin juillet est estimé à 250 millions d'euros par mois pour l'assurance maladie.


 Emploi : les vraies raisons des vagues de départs des salariés français
Emploi : les vraies raisons des vagues de départs des salariés français

Sujets les + commentés